Ricerca: Dal Mit la nanonavetta che, per ora nel topo, isola e uccide le cellule tumorali
Sull'ultimo Nature di luglio realizzato un nuovo dispositivo chemioterapico capace di ridurre nel topo la massa tumorale di melanoma. prossima tappa futura: rispondere specificamente ai diversi tipi di tumore solido nell'uomo.
06 agosto 2005
Dalla Divisione di Bioingegneria del Mit, il Massachusetts Insitute of Technology di Cambridge, arriva un'innovazione tecnologica strategica per la cura del cancro.
Ricordando che per ora è stata collaudata solo su cellule in coltura e su topo, e quindi con tutte le precauzioni e le giuste riserve, si fa davvero sempre più trafficata la via che porta alla guarigione dal vecchio "male incurabile".
L'articolo è stato pubblicato su Nature del 28 Luglio e i ricercatori, tutti del Mit, lo hanno presentato sottolineando che l'applicazione clinica è ancora lontana.
Capo della ricerca e autore dell'articolo è Ram Sasisekharan, responsabile della divisione di Ingegneria biologica del Mit, mentre primo nome è Shiladitya Sengupta che più da vicino si è occupato della giusta sequenzialità degli eventi e degli effetti terapeutici. Per ora i risultati ottenuti su modello animale, topo, sono evidenti e straordinari specie sul melanoma, neoplasia che risponde con una riduzione volumetrica della massa tumorale molto più evidente rispetto a quella ottenuta sul tumore polmonare di Lewis.
Queste due, quella del melanoma e del carcinoma polmonare di Lewis, sono le linee onco-cellulari su cui il nuovo farmaco è stato sperimentato.
Come funziona la nuova particella antitumorale? Intanto cominciamo col dire che è un farmaco bifasico, agisce cioè in due fasi successive, e poi che è una nanomolecola, siamo cioè nell'ordine di grandezza del miliardesimo di metro.
Le dimensioni e la composizione chimica sono caratteristiche essenziali quando si parla di farmaci che devono agire sistemicamente attraverso il circolo sanguigno, prima di tutto perché devono poter raggiungere liberamente qualsiasi distretto tessutale dove può annidarsi il tumore. Secondo perché devono essere biocompatibili, biodegradabili e non devono attivare il sistema immunitario.
Fino ad oggi tutti gli approcci di terapia clinica con farmaci anti-angiogenici dovevano superare due grosse difficoltà. La prima è che una volta che il farmaco ha distrutto i vasi sanguigni è impossibile procedere con una successiva somministrazione farmacologica, la prima distruggendo i vasi fa terra bruciata ad ogni ulteriore trattamento e quindi l'esito favorevole della terapia viene a dipendere dalla sola prima somministrazione.
La seconda è che l'ipossia indotta dai farmaci di questo tipo finisce col diventare un fattore di stimolo per il tumore che in seguito all'attivazione di particolari geni diventa più invasivo e metastatizza.
Tutte queste difficoltà sono state brillantemente superate con la nuova nanonavetta del Mit. Il rivestimento di colesterolo, fosfatidilcolina e acidi grassi nelle giuste proporzioni, permette alla nanonavetta di mimetizzarsi ed eludere la sorveglianza del sistema immunitario. Quindi può circolare liberamente nel flusso sanguigno e raggiungere indisturbata i vari distretti periferici.
Le piccole dimensioni le consentono inoltre di passare selettivamente attraverso le fessurazioni dei capillari che irrorano il tumore, i vasi sanguigni che irrorano le masse tumorali hanno infatti finestre parietali più grandi rispetto ai vasi di tessuti sani. A questo punto liberata nel tessuto neoplasico la nanonavetta si apre e rilascia il primo farmaco, l'agente antiangiogenico, che si trova nell'involucro più esterno fatto di acidi grassi naturali.
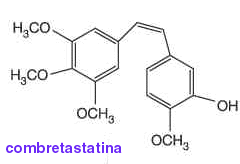
Nello studio i ricercatori hanno utilizzato come fattore antiangiogenico la combretastatina-A4, una molecola che facendo collassare il citoscheletro delle cellule endoteliali provoca la distruzione dei vasi e isola il tumore.
Una volta che si è liberata la combretastatina la nanonavetta entra nella sua seconda fase e libera un secondo killer chimico, la doxorubicina, un agente citotossico che coniugato ad un copolimero di acido glicolico e lattico (PLGA) viene liberato lentamente e in maniera ottimale.
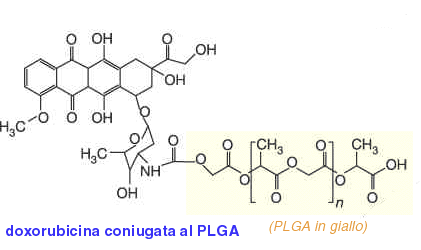
La doxorubicina è una molecola già conosciuta e utilizzata nella chemioterapia di routine. La novità introdotta con la navetta bifasica del Mit è che in questa maniera l'agente citotossico può agire direttamente in loco danneggiando solo le cellule tumorali dove viene rilasciato e quindi può essere utilizzato in dosi molto più contenute, e meno tossiche, rispetto alla terapia tradizionale. Come funziona la doxorubicina? quest'agente chimico esplica il suo effetto intercalandosi fra le basi del Dna e provocandone la frammentazione induce la morte per apoptosi della cellula neoplasica.
In toto la nuova strategia prevede dunque un'unica struttura capace di assolvere, in due fasi ben distinte e sequenziali, due diverse azioni antitumorali in grado prima di isolare il tumore e poi distruggerlo.
La strategia del farmaco intelligente non è nuova, da anni le menti dei più ingegnosi ricercatori e oncologi sono impegnate in questa direzione. In Italia il prof. Veronesi già alla fine degli anni '80 pensava agli anticorpi monoclonali che, caricati di chemioterapico, andavano ad agire nei distretti tessutali specifici e colpivano perciò solo la cellula trasformata.
Un'idea ancor più geniale considerati i tempi, ma mille difficoltà, e purtroppo non solo tecniche (gli incentivi italiani alla ricerca sono rinomati) hanno dato del filo da torcere alla sua completa realizzazione e applicazione clinica. Questa di oggi, non a caso targata Mit, grazie all'alto livello tecnologico raggiunto, supera brillantemente alcuni degli ostacoli più difficili che quest'approccio terapeutico presentava.
Il primo della serie è senza dubbio quello che gli anti-angiogenici impedendo al tumore di crescere di fatto evitano di far arrivare in loco il chemioterapico somministrato, il secondo è che l'ipossia indotta dall'antiangiogenico innesca una sorta di resistenza reattiva del tumore che diventa più resistente al processo di degradazione chemioterapica e mostra una maggiore potenzialità invasiva e metastatica.
La nuova nanonavetta supera bene questi due impasse anzi durante lo studio non solo si è osservata la regressione tumorale ma si è allungato anche l'intervallo di sopravvivenza che è arrivato nei topi trattati a 60 giorni contro i 30 dei topi sottoposti a classica chemioterapia e i 20 dei controlli non curati in alcun modo.
