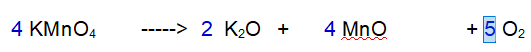esercizi svolti sul bilanciamento di reazioni chimiche
inserita 15-12-2020
Esercizi risolti
Livello medio
Doppio scambio tra fosfato di sodio e nitrato di potassio
“ Con formazione di fosfato di potassio e nitrato di sodio „
Reazione non bilanciata
Tipo di reazione: reazione di doppio scambio
1- La reazione da bilanciare è una tipica reazione di doppio scambio tra due sali.
I sali sono formati da ioni positivi (monoatomici o poliatomici) e ioni negativi (monoatomici o poliatomici).
Nella reazione di doppio scambio i sali si scambiano gli anioni.
Di seguito l'equazione di reazione con gli ioni separati
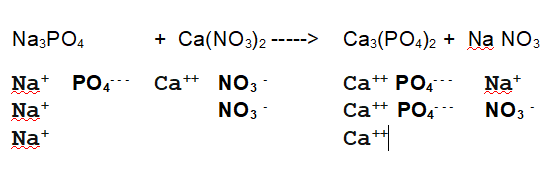
è bilanciata?
No. L'equazione non è bilanciata. Vuol dire che i sali non reagiscono in rapporto 1:1:1:1. In questo caso conviene cominciare a bilanciare i metalli.
Le reazioni di doppio scambio sono facilmente bilanciabili se uno ha occhio per riconoscere gli anioni poliatomici (che non possono essere alterati e vengono trasmessi in blocco). Ma anche se si procede per la via classica non sono per nulla difficili.
1- Calcio (Ca). Ce ne sono 1 a sinistra e 3 a destra. Mettiamo un 3 davanti al Nitrato di Calcio.

2 - Azoto (N). Ora ce ne sono 6 a sinistra e solo 1 a destra. Mettiamo un 6 davanti al Nitrato di Sodio
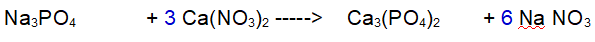
3 - Sodio (Na). Ora ne abbiamo 3 a sinistra e 6 a destra. Mettiamo un 2 davanti al Fosfato di Sodio
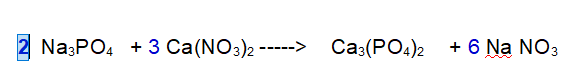
FINITA! Se controlliamo il numero di atomi di Ossigeno e Fosforo sono bilanciati.
QUINDI: 2 Fosfato di Sodio reagiscono con 3 Nitrato di Calcio per dare 1 Fosfato di Calcio e 6 Nitrato di Sodio.
Video-esempio con le simulazioni PHET
Link di riferimento:
PHET - Bilanciamento reazioni
PHET - Reagenti, prodotti e residui
Esercizi risolti
Livello avanzato
Ossidazione del Tellurio
“ Reazione del Tellurio con acido Nitrico „
Reazione non bilanciata

Tipo di reazione: ossidoriduzione
Reazione in cui sono coinvolte delle ossidoriduzioni.
La risolviamo con le regole semplici di bilanciamento.
In questo caso il Tellurio viene ossidato dall'Azoto in ambiente acido
è bilanciata?
No. L'equazione non è bilanciata. In questo caso conviene cominciare dall'Idrogeno.
1- Idrogeno (H). 1 a sinistra e 2 a destra. Mettiamo un 2 davanti all'acido nitrico.
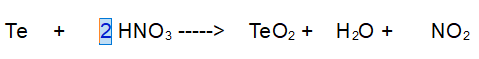
2- Azoto (N). Ora ne abbiamo 2 a sinistra e uno a destra. Mettiamo un 2 davanti al diossido di azoto.
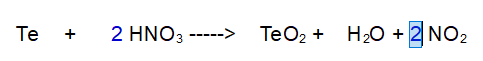
3- Ossigeno (O). Ci accorgiamo che a destra ne abbiamo 7 e a sinistra solo 6.
Operiamo sull'acqua, dove è dispari, ma contemporaneamente aggiustiamo anche l'idrogeno che varia a causa della nostra azione.
Mettiamo un 2 davanti all'acqua e un 4 davanti all'acido nitrico.
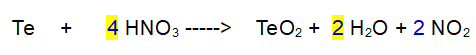
4- Azoto (N) di nuovo. Mettiamo un 4 davanti al diossido di azoto.
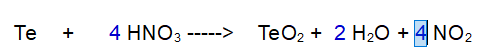
FINITA: Se controlliamo il numero di atomi di Ossigeno e Zolfo sono bilanciati.
QUINDI: Per ossidare 1 atomo di Tellurio occorrono 4 molecole di acido nitrico.
Appendice:
Dato che è una reazione redox verifichiamo che il numero di elettroni ceduti dal Tellurio (il cui numero di ossidazione passa da 0 a +4) nella reazione bilanciata sia uguale a quello di elettroni ricevuti dall'Azoto (il cui numero di ossidazione passa da +5 a +4)
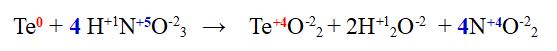
semireazione di ossidazione del Tellurio Te0 --> Te+4 + 4 e-
semireazione di riduzione dell'azoto 4N+5 + 4 e- --> 4N +4
Il numero di elettroni è lo stesso per cui abbiamo verificato che la redox è correttamente bilanciata anche nel numero di elettroni scambiati
Esercizi risolti
Livello medio
Decomposizione del permanganato di Potassio
“ con formazione di Ossido di Potassio, Ossido di Manganese e Ossigeno „
Reazione non bilanciata
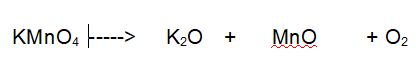
Tipo di reazione: decomposizione
La terza reazione è una decomposizione. Il Permanganato di Potassio si decompone in Ossido di Potassio, Ossido di Manganese e Ossigeno molecolare.
è bilanciata?
No. Il Potassio non è bilanciato. 1 a destra e 2 a sinistra.
Cominciamo ad aggiustare il Potassio (K)
1 - Potassio (K). Siccome ci sono due atomi di potassio nell'ossido devono reagire due particelle di Permanganato di Potassio.
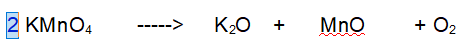
2 - Manganese (Mn). Ora abbiamo due atomi di Manganese a sinistra per cui ce ne devono essere 2 a destra.
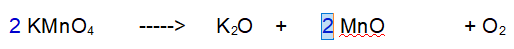
3 - Ossigeno (O). Ne abbiamo 8 a sinistra e 5 a destra. Raddoppiamo tutto tranne l'Ossigeno.
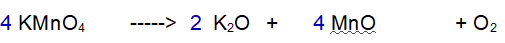
4 - Ossigeno (O). Ora ne abbiamo 16 a sinistra e 8 a destra. Occorrono 5 molecole di Ossigeno totali per bilanciare la reazione.