reagente limitante e reagente in eccesso
inserita 08-05-2020
Reagente limitante
elementi fondamentali
“ Quando la quantità dei due reagenti non è perfettamente bilanciata „
Nel post precedente, Calcoli stechiometrici Elementi Fondamentali, abbiamo imparato a effettuare i calcoli stechiometrici, con una semplice tabella, passando dalla quantità in grammi di una sostanza, al numero di moli, rapportando il numero di moli di un reagente alle moli del prodotto che si forma in base ai coefficienti stechiometrici, per poi concludere con la quantità in grammi del prodotto.
In questo caso generale non ci siamo preoccupati di considerare la possibilità che i rapporti in massa dei due reagenti non fossero perfettamente bilanciati: la maggior parte delle volte però, uno dei due reagenti può essere presente in quantità insufficiente per effettuare la reazione con l'altro reagente.
Il Reagente Limitante
Nel corso della reazione il reagente insufficiente REAGENTE LIMITANTE si consuma completamente quando ancora c'è un residuo dell'altro reagente REAGENTE IN ECCESSO e la reazione quindi SI BLOCCA.
Il Reagente limitante è quindi il reagente che dirige la reazione. La quantità di Reagente limitante determina quando la reazione si interromperà, non importa quanto degli altri reagenti sia ancora presente nel recipiente.
Il Reagente in Eccesso
Se quindi non ho bilanciato perfettamente la quantità in grammi dei due reagenti, nel recipiente di reazione mi resterà sempre una quantità eccedente degli altri reagenti. oltre ai prodotti resta una certa quantità del reagente in eccesso.
facciamo un esempio: Ossidazione del benzene
L'ossidazione del Benzene
“ Bilanciamo la reazione di ossidazione del benzene „
Il Benzene è un anello aromatico di formula C6H6 che può essere completamente ossidato dall'Ossigeno ad anidride carbonica e acqua.
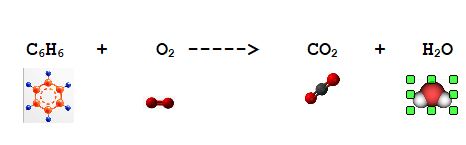
Prima di tutto bilanciamo la reazione
1- Bilanciamo il carbonio
A sinistra ce ne sono 6 nel benzene per cui si formeranno 6 molecole di anidride carbonica
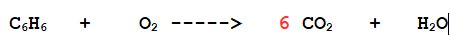
2- Bilanciamo l'idrogeno
a destra ce ne sono 6 a sinistra 2 per cui si formeranno 3 molecole di acqua
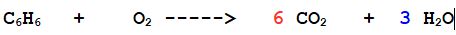
3- Per l'ossigeno c'è prima di tutto il problema che a sinistra è pari e a destra è dispari.
Raddoppiamo tutte le sostanze tranne l'ossigeno molecolare che lo possiamo tranquillamente lasciare per ultimo, tanto è da solo
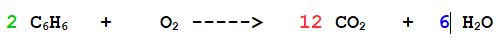
4- ora aggiustiamo l'Ossigeno
A destra ce ne sono complessivamente 24+6=30
per cui occorreranno 15 molecole di Ossigeno per bilanciare l'equazione

Quindi per ottenere una reazione completa, ogni due molecole o due moli di Benzene occorrono 15 molecole o 15 moli di Ossigeno per avere una reazione totale; in questo caso si formeranno 12 moli di anidride carbonica e 6 di acqua.
Nel caso questi rapporti non siano rispettati uno dei due reagenti si consumerà per primo e la reazione si bloccherà.
Per cui anche se l'altro reagente è in eccesso sarà impossibilitato a portare avanti la reazione e resterà nel recipiente.
In base a questa reazione risolviamo di seguito un problema di reagente limitante e reagente in eccesso
Un problema con il reagente limitante
“ Vediamo come si risolve un problema con reagente limitante e in eccesso „
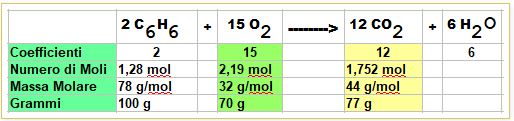
PROBLEMA: metto a reagire 100 grammi di Benzene con 70 grammi di Ossigeno. Quanti grammi di anidride carbonica si formano a reazione completata?
Impostiamo la tabella:

Calcoliamo le moli di Benzene e Ossigeno disponibili

In questo caso si vede a occhio che, nonostante le moli di Ossigeno siano superiori a quelle del Benzene sono largamente insufficienti per consumare tutto il Benzene.
In quanto per ogni due moli di Benzene ne occorrono ben 15 di Ossigeno per completare la reazione.
Verifichiamolo comunque con una semplice proporzione
1,28 : 2 = X : 15 ------> per cui 9,6 moli di Ossigeno sarebbero necessarie per consumare tutto il benzene.
Per cui l'Ossigeno è il REAGENTE LIMITANTE e sarà quello che deciderà l'arresto della reazione
SECONDO PASSAGGIO:
Ora posso calcolare quanta Anidride Carbonica si è formata una volta consumato tutto l'Ossigeno come spiegato nel post precedente
A questo punto posso anche calcolare quanto Benzene mi è rimasto nel recipiente IN ECCESSO
2,19 moli di Ossigeno : 15 = X (moli di benzene che hanno reagito) : 2
= 0,29 moli di benzene pari a 22,78 grammi
per cui mi restano 77,22 grammi di benzene che non hanno reagito
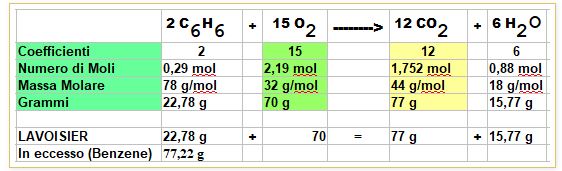
Posso controllare con la legge di Lavoisier (massa dei reagenti = massa dei prodotti) il risultato.
La prossima lezione prenderà in esame il concetto di resa di reazione.
