Reazioni di Decomposizione
inserita 09-02-2021
Introduzione
reazioni di decomposizione e reazioni di sintesi
“ Per le reazioni di sintesi consultate i post: reazioni di sintesi (1) e reazioni di sintesi (2) „
Le reazioni di decomposizione sono una classe di reazioni che sono concettualmente l'inverso delle reazioni di sintesi trattate nei post precedenti.
Questo non vuol dire che tutte le reazioni che abbiamo trattato nei post precedenti possano spontaneamente tornare indietro e riformare i composti di partenza.
Se una sostanza è decomponibile dipende dalla stabilità del composto formato e spesso le vie della decomposizione sono diverse da quelle della sintesi.
Schema di Reazione
In una reazione di decomposizione abbiamo un composto di partenza, ionico o molecolare, che si "spezza" in 2 o più composti.
A -----> B + C + (D)
Ovviamente la maggior parte delle sostanze, anche quelle più stabili, possono andare incontro, nelle opportune condizioni e attraverso catene di reazioni più o meno complesse, a decomposizione.
In molti casi le reazioni sono favorite da catalizzatori o dal semplice apporto di energia sotto forma di calore, alte temperature, o luce.
Per quanto riguarda la chimica inorganica si prendono in considerazione principalmente solo alcune reazioni di decomposizione che coinvolgono gruppi specifici di composti chimici: le più importanti sono quelle che comportano formazione come prodotto di anidride carbonica, di ossigeno o di acqua.
1- Decomposizioni con liberazione di anidride carbonica
“ decomposizione dei carbonati „
In questo gruppo di reazioni una delle sostanze che si forma dal processo di decomposizione è l'Anidride Carbonica. I principali protagonisti di reazioni di questo tipo sono i Carbonati e i Bicarbonati.
CARBONATI
Sali ternari ossigenati derivati comunemente dalla reazione dell'acido carbonico con basi, ad esempio idrossidi.
La loro decomposizione ad alte temperature non comporta la riformazione dei composti originali ma la formazione di un Ossido e anidride carbonica.
Prendiamo come esempio uno dei più importanti carbonati, il Carbonato di Calcio, componente fondamentale di rocce che chiamiamo carbonatiche o calcaree.
Possiamo ottenere facilmente Carbonato di Calcio dalla reazione di neutralizzazione tra Acido Carbonico e Idrossido di Calcio oppure dalla reazione tra idrossido di Calcio in soluzione e anidride carbonica.
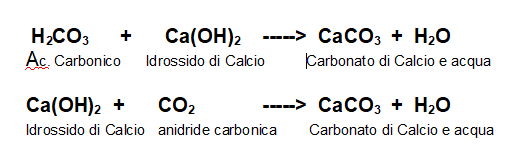
In una reazione di decomposizione, per definizione, non posso far reagire il Carbonato con niente, si deve decomporre, per cui non posso invertire queste strade percorse per la sua formazione.
Il Carbonato di Calcio si decompone secondo la seguente reazione, ad alte temperature. Quindi c'è la necessità di fornire una grande quantità di energia per ottenere la decomposizione e la reazione è fortemente endoergonica.
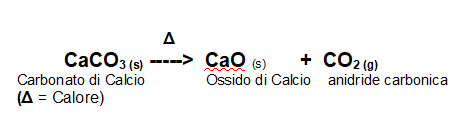
Questa reazione di decomposizione è comune a tutti i Carbonati, tranne quelli del primo gruppo, che quindi formano il corrispettivo Ossido Metallico e anidride carbonica.
BICARBONATI
I bicarbonati sono sali quaternari contenenti oltre all'Ossigeno anche l'Idrogeno.
La loro decomposizione genera il corrispettivo Carbonato e anidride carbonica e acqua.

2- Decomposizioni con liberazione di Ossigeno
i clorati
“ i clorati si decompongono rilasciando Ossigeno „
Tra le reazioni di decomposizione con liberazione di Ossigeno è opportuno ricordare quelle dei clorati che si decompongono in sali binari e Ossigeno.
Come risolvere una semireazione di decomposizione di questo tipo?
Quali sono i prodotti della reazione di decomposizione di un clorato?
Ricordiamo che:
a- Nel sale binario l'Ossigeno non c'è più, c'è solo il metallo e il non-Metallo.
b-lo stato di ossidazione del metallo non cambia. Se ha una carica positiva in partenza la ha anche alla fine.
c- l'ossigeno viene liberato come molecola biatomica.
Prendiamo come esempio la decomposizione del clorato di sodio.
Il Clorato, composto ionico formato da un catione sodio e un anione clorato si decompone in cloruro di sodio e ossigeno.

si risolve semplicemente in questo modo

3- Decomposizioni con liberazione di acqua
Idrossidi
“ Decomposizione degli Idrossidi „
Quelle da ricordare sono le decomposizioni degli idrossidi, tranne quelli contenenti i metalli del primo gruppo, che non si decompongono comunemente ad alte temperature.
Come risolvere una semireazione di decomposizione di questo tipo?
Quali sono i prodotti della reazione di decomposizione di un idrossido?
Queste sono assolutamente le più semplici se avete capito le reazioni di sintesi degli idrossidi.
ricordiamo che:
a- Un idrossido è una molecola ionica contenente uno o più ioni OH- e uno ione metallico di carica positiva corrispondete al numero di ioni idrossido.
b- lo stato di ossidazione del metallo non cambia. Se ha una carica positiva in partenza la ha anche alla fine.
c- si forma l'ossido di partenza e acqua
Prendiamo come esempio la decomposizione dell'idrossido di alluminio.

La reazione completa è questa (non bilanciata)
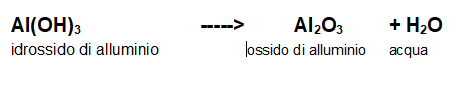
La reazione bilanciata è questa
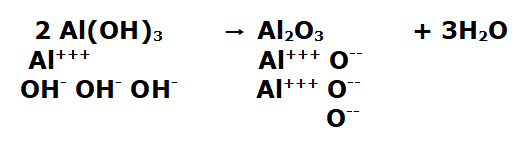
4 - Altre reazioni che potete incontrare:
Decomposizione dell'acqua ossigenata
L'acqua ossigenata si decompone abbastanza rapidamente se esposta alla luce o al calore, liberando Ossigeno e acqua.
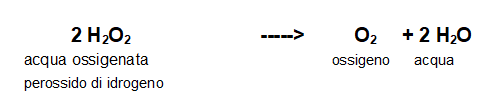
Decomposizione dei sali binari
Molti sali binari si possono decomporre restituendo gli elementi di partenza. (in questo caso la decomposizione è proprio l'inverso della reazione di sintesi)
Ad esempio il cloruro di argento e lo ioduro d'argento sono sensibili alla luce e si possono decomporre precipitando l'argento, reazioni utilizzate nella fotografia.

