Molarità di una soluzione
Come calcolare la molarità di una soluzione
inserita il 30-03-2021
Procedimento e calcolatore automatico
“ Che cos'è la molarità „
La molarità (M) o concentrazione molare è una delle unità di misura più usate in chimica per determinare la concentrazione di un soluto in una soluzione.
Cosa vuol dire determinare la concentrazione?
Calcolare la quantità di soluto, in grammi, in numero di particelle o in moli, sciolta in un volume o in una quantità di soluzione. Di modo che se io prelevo una certa quantità di soluzione so con precisione quanto soluto è contenuto nel mio campione.
Per quanto riguarda la molarità è un'unità di concentrazione definita come quantità di soluto espressa in moli per quantità di soluzione espressa in Litri.
Nei laboratori di chimica abbiamo soluzioni liquide il cui solvente è in genere l'acqua, ma la molarità può essere usata per qualsiasi soluzione liquida in quanto la grandezza interessata è, come abbiamo detto, il VOLUME della soluzione.
La formula della Molarità è quindi molto semplice.

Però questa formula non è quasi mai sufficiente per risolvere un problema di concentrazione.
Infatti in una normale pratica laboratoriale noi usiamo pesare la quantità in grammi di una sostanza che stiamo sciogliendo nella soluzione.
PROBLEMA: Ci occorre quindi una seconda formula per mettere in relazione il numero di moli con la quantità pesata in grammi.
La formula che ci permette di risolvere il problema è insita stessa nella definizione di mole.
La mole è una delle 7 grandezze fondamentali e rappresenta la Quantità di Sostanza. Una grandezza che esprime il numero di particelle di sostanza (per esempio nel caso dell'acqua il numero di molecole di H2O)
Una definizione operativa di mole, senza entrare troppo nella teoria è questa:
1 mole di sostanza è una quantità in grammi della sostanza pari al peso molecolare o massa molecolare della sostanza stessa.
Cosa significa? E come posso calcolare la massa molare?
Nel caso stessimo parlando di atomi è molto semplice:
Nella tavola periodica per ogni atomo è indicato il numero atomico e una grandezza chiamata Massa Atomica Relativa.
Una mole di atomi di quell'elemento è la quantità in grammi pari alla loro Massa Atomica Relativa.
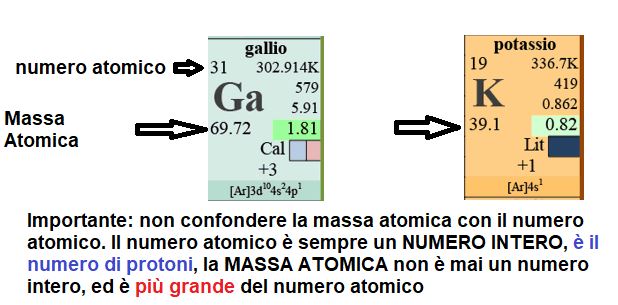
Negli esempi in figura:
1- Una mole di Gallio (Ga) corrisponde a 69,72 grammi di Gallio.
2- Una mole di Potassio (K) corrisponde a 39,10 grammi di Potassio.
In generale per calcolare il numero di moli di sostanza (in questo caso di atomi) basta dividere i grammi di sostanza che abbiamo pesato, o stiamo prendendo in considerazione, per il valore della sua Massa Molare (la massa in grammi di una mole di sostanza - per il Gallio 69,72 grammi e per il Potassio 39,10 grammi).

Chiaramente se peso 69,72 grammi di Gallio / 69,72 grammi di Massa Molare ottengo 1 mole.
Se peso 39,10 grammi di Potassio / 39,10 grammi di Massa Molare ottengo 1 mole
Perché mi serve la mole e non mi basta la massa?
Nelle reazioni chimiche e nelle interazioni tra atomi e molecole ogni composto o elemento reagisce con altri composti o elementi in precisi rapporti numerici. Per esempio nella reazione
2 H2 + O2 --> 2 H2O
2 molecole di Idrogeno reagiscono con 1 molecola di Ossigeno per sintetizzare 2 molecole di Acqua.
Quindi non ci sono i GRAMMI nella reazione ma il NUMERO DELLE MOLECOLE.
La Mole mi permette proprio di mettere in relazione e di sapere quante molecole sono contenute in un TOT grammi di sostanza.
In quanto, come abbiamo visto sopra, ogni atomo ha una sua massa e se prendessi lo stesso numero di grammi di Gallio e Potassio avrei un numero di particelle molto diverso (dato che il Potassio ha una massa di circa la metà prenderei quasi il doppio di atomi di potassio rispetto a quelli di Gallio).
Se prendo lo stesso numero di moli invece prendo LO STESSO NUMERO DI MOLECOLE delle due sostanze; se ne prendo il doppio avrò il doppio del numero di molecole e così via.
Per cui nella reazione di sintesi dell'acqua DEVO prendere:
2 moli di Idrogeno molecolare (4,032 grammi di Idrogeno) + 1 mole di Ossigeno molecolare (32 grammi di Ossigeno) e ottengo 2 moli di acqua (36,032 grammi di acqua).
Questi argomenti li ho trattato in dettaglio nelle pagine dei CALCOLI STECHIOMETRICI e del BILANCIAMENTO DELLE REAZIONI.
Come calcolare il numero di moli di un composto
Quando si deve affrontare un esercizio di molarità comunemente non abbiamo di fronte atomi di soluto, ma MOLECOLE di soluto (o FORMULE MINIME nel caso di composti ionici).
Ad esempio Cloruro di Sodio (NaCl) in acqua.
Come faccio a calcolare la Massa Molare del Cloruro di Sodio?
La risposta è molto semplice.
Per la legge di Lavoisier quando avviene una reazione chimica la massa dei reagenti DEVE essere uguale alla massa dei prodotti, per cui, anche se sottoposti a una reazione chimica la massa dei singoli elementi resta costante.
Quindi per calcolare la Massa Molare di una molecola, basta sommare le masse dei singoli elementi che la compongono, sempre ricavabili dalla tavola periodica degli elementi, tenendo conto ovviamente del NUMERO di atomi di OGNI elemento presenti nella formula della molecola o del composto.
Nel Cloruro di Sodio, composto ionico, NaCl ci sono soltanto UN atomo di Sodio e UN atomo di Cloro (quando non ci sono numeretti a destra del simbolo dell'elemento si sottintende il valore 1.
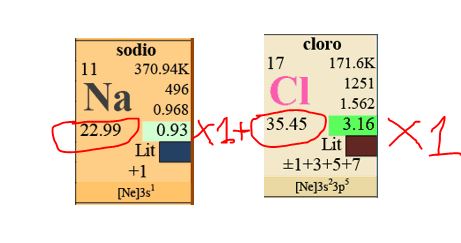
Mm = 22,99 + 35,45 --> 58,44 grammi/mole
Quindi una mole di Cloruro di Sodio ha una Massa Molare di 58,44 grammi.
Nel caso siano presenti più atomi di ogni elemento basta moltiplicare la massa molare di ogni singolo elemento per il numero di atomi presenti e sommare il tutto.
Prendiamo ad esempio il Glucosio: C6H12O6
Una molecola di Glucosio contiene quindi:
6 atomi di CARBONIO + 12 atomi di IDROGENO + 6 atomi di OSSIGENO.
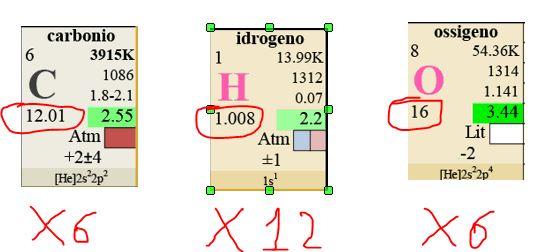
La sua Massa Molare è quindi:
(12,01 x 6) + (1,008 x 12) + (16 x 6) = 180,156 grammi/mole
Quante particelle (in questo caso atomi) sono contenute in una mole di sostanza?
In alcuni esercizi le grandezze incognite possono essere non solo le moli, i grammi di sostanza o la Molarità, ma anche il numero di particelle (atomi o molecole o ioni) contenute in quella quantità di sostanza.
Come facciamo a calcolarli?
La risposta è molto sempice: una mole di sostanza contiene sempre lo stesso numero di particelle, pari a un numero o costante di avogadro di particelle, che si indica con il simbolo NA
Quanto vale la costante di Avogadro?
Guardiamo il problema dal punto di vista matematico, semplicemente mettendo il relazione le unità di misura della massa, in questo caso non prendiamo il chilogrammo ma il grammo in quanto la definizione di mole si basa sulla massa in grammi, e le unità di misura della massa di un singolo atomo, molecola o ione, in definitiva di una singola particella.
L'unità di massa atomica è estremamente piccola. Rappresenta la dodicesima parte della massa di un atomo di Carbonio.
Se esprimo questo valore in grammi ottengo, per l'appunto, un numero estremamente piccolo: 1,66054 x 10-24 g
I valori delle masse degli atomi che sono riportati nella tavola periodica sono appunto messi in relazione con la dodicesima parte della massa di un atomo di carbonio
Ad esempio l'Idrogeno (monoatomico per semplificare) ha una massa atomica relativa di 1,008, cioè 1,008 volte la dodicesima parte dell'atomo di Carbonio.
Come abbiamo detto sopra quando prendo una mole di sostanza prendo una quantità in grammi di sostanza pari al valore della sua massa atomica relativa cioè 1,008 grammi.
Quanti atomi di Idrogeno ci sono quindi in una mole di idrogeno? (sempre monoatomico per semplificare)
Devo dividere ovviamente il numero di grammi della sostanza per la massa in grammi di un singolo atomo di idrogeno.
N (numero di atomi di Idrogeno) = Massa dell'Idrogeno in questione 1,008 g / (massa in grammi di UN atomo di idrogeno 1,008 x 1,66054 x 10-24 g)
quindi N = 1,008 g/(1,008 x 1,66054 x 10-24) g, semplificando per 1,008 sotto e sopra -->1/1,66054x10-24
questo valore è proprio quello che chiamiamo Costante di Avogadro cioè 6,022 x 1023.
Questo valore di indica appunto con la sigla NA
Formulario finale su Molarità, massa, numero di moli e numero di particelle
Il numero di Avogadro
rappresenta il numero di particelle (atomi, molecole o altre entità) presenti in una mole di una sostanza, ovvero 6,022 x 10^23 particelle per mole.
La mole
è l'unità di misura utilizzata per esprimere la quantità di una sostanza. Un mole di una sostanza contiene esattamente il numero di particelle corrispondente al numero di Avogadro.
La massa molare
è la massa di una mole di una sostanza, espressa in grammi. La massa molare si ottiene sommando le masse atomiche dei singoli atomi che compongono la molecola.
L'unità di massa atomica (uma)
è la massa di un atomo in unità di massa atomiche, che è definita come un dodicesimo della massa di un atomo di carbonio-12. In altre parole, l'uma rappresenta la massa di un singolo atomo espresso in relazione alla massa dell'atomo di carbonio-12.
Le formule da utilizzare sono le seguenti:
La Molarità (M) di una sostanza è uguale al numero di moli della sostanza (n) divisa per il Volume (V) della SOLUZIONE espresso in Litri:
M = n / V
Il numero di moli (n) di una sostanza è uguale alla massa della sostanza (mg) espressa in grammi, divisa per la massa molare (Mm) della sostanza in grammi per mole:
n = mg / Mm
La massa della sostanza (mg) espressa in grammi è uguale al numero di moli (n) della sostanza moltiplicato per la massa molare (Mm) della sostanza in grammi per mole:
m = n x Mm
Il numero di particelle (N) di una sostanza è uguale al numero di moli (n) della sostanza moltiplicato per il numero di Avogadro (NA):
N = n x NA
La massa molecolare (Mm) di una sostanza la ricaviamo dalla tavola periodica ed è uguale alla somma delle masse atomiche dei singoli atomi che compongono la molecola, espresse in unità di massa atomica (uma):
Mm = (numero di atomi elemento1 x uma1) + (numero di atomi elemento2 x uma2) + (numero di atomi elemento3 x uma3) + ...
Queste relazioni possono essere utilizzate per convertire le grandezze tra loro. Ad esempio, per calcolare il numero di particelle (N) in 5 grammi di idrogeno (H2), dobbiamo prima calcolare il numero di moli (n) di idrogeno usando la formula
n = mg / Mm.
La massa molare dell'idrogeno è di circa 2 grammi per mole (2 g/mol), quindi:
n = 5 g / 2 g/mol = 2.5 mol
Quindi, per calcolare il numero di particelle di idrogeno, moltiplichiamo il numero di moli per il numero di Avogadro (NA):
N = n x NA = 2.5 mol x 6,022 x 10^23 particelle/mol = 1.5055 x 10^24 particelle.
Calcolatore della molarità di una soluzione
Con questo calcolatore della molarità potete risolvere i vari problemi che dovete affrontare a lezione o nei compiti. Usatelo per verificare se avete risposto correttamente.
Istruzioni
Primo form:
inserite i dati in due dei tre campi per ottenere gli altri valori.
Ad esempio
se avete come termini noti il numero di moli e la Massa molare potete trovare la massa in grammi;
se avete la massa in grammi e la massa molare il numero di moli;
se avete la massa in grammi e il numero di moli vi ricavate la massa molare.
In tutti i casi nell'ultimo campo vi compare il numero di particelle
Il secondo form vi permette di calcolare la molarità inserendo il numero di moli e il Volume, o il Volume inserendo molarità e numero di moli oppure il numero di moli inserendo molarità e volume
Il widget inserito all'interno della pagina vi permette invece di calcolare la massa molare semplicemente scrivendo (correttamente) la formula chimica della sostanza.
NB: i decimali vanno preceduti dal punto e non dalla virgola
by The JavaScript Source
Pagina successiva - esercizi svolti sulla molarità (1)
Concentrazioni delle soluzioni chimiche
Calcolo della Molarità, delle moli e Numero di Avogadro - teoria e calcolatore online
molalità e concentrazione molale
esercizi svolti sulla molarità (1)
esercizi svolti sulla molarità (2)
esercizi svolti sulla molalità (1)
esercizi svolti sulla molalità (2)
esercizi svolti sulla molalità (3)
esercizi svolti da molarità a molalità
esercizi svolti da molalità a molarità
Le concentrazioni percentuali m/m esercizi svolti (1)
Le concentrazioni percentuali m/V esercizi svolti (2)
Le concentrazioni percentuali V/V esercizi svolti (3)
Altri argomenti di chimica
Il bilanciamento di reazioni chimiche
Altri convertitori
Calcolo della Molarità, delle moli e Numero di Avogadro - teoria e calcolatore online
tabelle
tabelle riassuntive su Mercurio
tabelle riassuntive su Plutone
Apps e Test
